HBV感染是全球重要公共卫生问题之一[1-2]。但由于对HBV生命周期的认识还不够充分,目前尚缺乏有效治愈慢性乙型肝炎(CHB)的药物。因此,深入解析HBV复制的调控机制,将为抗HBV新药物研发提供有效靶点。
HBV属嗜肝DNA病毒科病毒,基因组为部分双链的松弛环状DNA(rcDNA),其复制过程有着独特的逆转录步骤[3]。研究[4-5]表明,HBV的复制依赖于肝细胞的细胞周期。例如,HBV在静止肝细胞中的复制更为活跃,而在细胞开始分裂时复制减慢。细胞周期素D1(cyclinD1,基因名CCND1)是细胞周期进程的正性调节因子,可通过结合并激活细胞周期素依赖性激酶(CDK)4、6,促进细胞由静止期(G0)或间期1(G1)进入DNA合成期(S)。研究[6-7]发现,cyclinD1在包括肝癌在内的多种肿瘤组织中呈异常高表达,但cyclinD1是否影响HBV复制目前尚未见报道。本研究通过挖掘公共数据库数据以及应用HBV复制细胞模型,探究cyclinD1对HBV复制的影响,并对其调控HBV复制的可能机制进行分析。
1材料与方法
1.1材料
人肝癌细胞系HepG2购自美国ATCC数据库,Huh-7细胞购自上海中科院细胞库。pFLEX-cyclinD1-T286A、pGL3-HBVBCP、Actin-Renilla和pGL3-basic质粒为本室前期保存构建。prcccDNA/pCMV-Cre重组质粒系统由prcccDNA质粒和pCMV-Cre表达质粒组成[8],为复旦大学基础医学院邓强教授惠赠。
1.2细胞培养与转染HepG2和Huh-7细胞均采用含10%胎牛血清和100U/mL青霉素、链霉素的DMEM培养基,在37℃和含5%CO2的细胞培养箱中常规培养。细胞转染前1天,将生长状态良好的细胞按1.5×105个/孔接种至12孔板,其中HepG2细胞接种前需铺好鼠尾胶原。按照LipofectamineTM2000(购自美国Invitrogen公司)说明书进行质粒转染,6h后更换新鲜培养基继续培养,72h后收集培养上清及细胞沉淀用于后续实验研究。
1.3质粒构建采用同源重组的方法构建pCMV-cyclinD1表达质粒,其中扩增cyclinD1编码区的引物序列为:上游5′-ATTGTACCCGCGGGCCATGGAACACCAGCTCCTGTGC-3′,下游5′-GGATCCCCGCGGCCGCGTCACTTGTCATCGTCATCCTTGTAATC-3′。cyclinD1持续激活突变体表达质粒pCMV-cyclinD1-T286A是在pFLEX-cyclinD1-T286A质粒基础上,采用双酶切连接的方法构建而成。上述质粒DNA的序列均经测序验证[测序由生工生物工程(上海)股份有限公司完成]。
1.4HBsAg和HBeAg检测使用时间分辨免疫荧光法检测细胞培养上清中HBsAg和HBeAg,检测试剂盒购自苏州新波生物技术公司。所用检测设备为SYM-BIOAnytest时间分辨荧光分析仪(上海新波生物技术有限公司)。
1.5HBVDNA定量检测细胞培养上清用3000r/min离心3min,吸取200μL上清首先进行95℃加热10min,使病毒蛋白变性,然后使用LightCycle480Ⅱ实时荧光定量PCR仪和罗氏2×SYBRGreenMix进行HBVDNA相对定量检测。上游引物序列为5′-CGGCGTTTTATCATMTTCCTCT-3′,下游引物序列为5′-GACAAACGGGCAACATACCTT-3′。
1.6反转录-实时荧光定量PCR(RT-qPCR)实验Trizol法提取细胞总RNA,采用Roche反转录试剂盒(购自美国罗氏公司)逆转录为cDNA。取2μLcDNA为模板,使用2×SYBRGreenMix(购自美国罗氏公司)进行实时荧光定量PCR检测细胞内HBVmRNA表达水平,以管家基因ACTIN作为内参。HBVRNA检测所用引物序列如下:3.5kbHBVRNA上游引物为5′-AGACCACCAAATGCCCCTATC-3′,下游引物为5′-TCTGCGAGGCGAGGGAGTTC-3′,可检测pgRNA和preCmRNA两种RNA;preCmRNA上游引物为5′-TCTGCGCACCAGCACCATG-3′,下游引物为5′-CAATGCTCAGGAGACTCTAAGGC-3′。宿主基因APOBEC3G上游引物为5′-GCATCGTGACCAGGAGTATGA-3′,下游引物为5′-GTCAGGGTAACCTTCGGGT-3′;牛磺胆酸钠共转运多肽(NTCP)上游引物为5′-AAGGACAAGGTGCCCTATAAAGG-3′,下游引物为5′-TTGAGGACGATCCCTATGGTG-3′;肝细胞核因子1α(HNF1α)上游引物为5′-AACACCTCAACAAGGGCACTC-3′,下游引物为5′-CCCCACTTGAAACGGTTCCT-3′;染色体结构维持复合物5(SMC5)上游引物为5′-TCCCGAGAGACCCTTCGTC-3′,下游引物为5′-TTCCATTGGCTCCAACGATCA-3′;叉头盒转录基因M1(FOXM1)上游引物为5′-ATACGTGGATTGAGGACCACT-3′,下游引物为5′-TCCAATGTCAAGTAGCGGTTG-3′;ACTIN的上游引物为5′-TTGTTACAGGAAGTCCCTTGCC-3′,下游引物为5′-ATGCTATCACCTCCCCTGTGTG-3′。
1.7Westernblot实验收集细胞沉淀,加入约细胞体积3倍的RIPA裂解液,冰上裂解30min,12000×g、4℃离心10min后取上清,BCA蛋白定量试剂盒测定蛋白浓度。SDS-PAGE电泳分离蛋白后转移至PVDF膜上,5%脱脂奶粉室温封闭60min,按各抗体说明书使用量稀释后加入适量一抗4℃摇床杂交过夜,加入二抗(二抗原液按1∶8000稀释)室温孵育2h。使用Odyssey双色红外激光成像系统(美国LICOR公司)和软件进行杂交膜的扫描和分析。
1.8双荧光素酶活性检测为了确定cyclinD1对HBV基本核心启动子(BCP)活性的影响,将带有HBVBCP区的pGL3荧光素酶报告载体(pGL3-HBVBCP)与pCMV-cyclinD1或pCMV-cyclinD1-T286A共转染HepG2细胞,同时共转Actin-Renilla质粒作为内参对照。转染48h后,使用DualLuciferaseReporterAssay试剂盒中的PassiveLysisBuffer裂解细胞,吸取25μL上清检测萤火虫和海肾萤光素酶活性,以萤火虫/海肾的比值表示报告基因的活性。所用设备为多功能酶标仪(PerkinElmer公司)。
1.9数据下载与分析在GEO数据库(GeneExpressionOmnibus,)下载转录组数据集GSE84044和GSE83148[9-10]。GSE84044收录了124例HBV相关肝纤维化患者肝组织的转录组数据,GSE83148收录了122例CHB患者肝组织的转录组数据。通过limma包[11],对下载的数据进行了归一化处理。在分析与HBVDNA相关的宿主基因时,选择了GSE84044数据集中性别为男性且血清HBVDNA载量大于104拷贝/mL的患者共计59例。
2结果
2.1肝组织CCND1表达水平与血清HBVDNA载量呈负相关
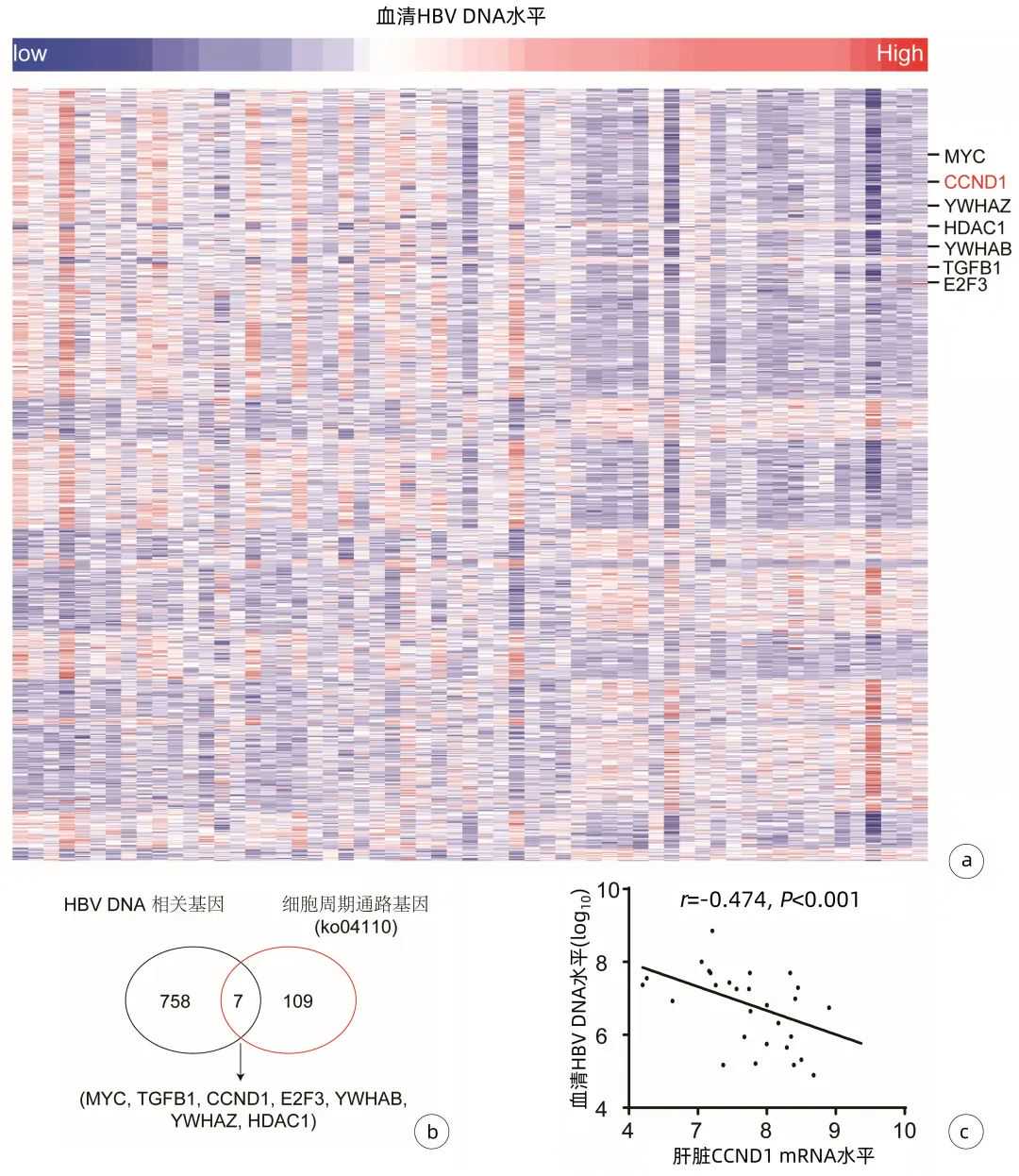
通过分析GSE84044数据集中59例男性HBV相关肝纤维化患者肝组织的转录组数据,共找到了765个表达水平与患者血清HBVDNA水平显著相关的宿主基因(FDR<0.05,|r|>0.3,图1a)。通过与116个细胞周期基因(ko04110)取交集,发现其中有7个基因为细胞周期相关基因,且这7个基因在肝脏中的表达水平均与血清HBVDNA水平呈显著负相关(FDR<0.05,r值均<-0.3,P值均<0.05)(图1a、1b),按相关性由强到弱排序依次为MYC、TGFB1、CCND1、YWHAZ、HDAC1、YWHAB和E2F3。其中,CCND1是调控细胞从G0/G1期向S期转换的关键因子,其表达水平与HBVDNA载量呈显著负相关(r=-0.474,P<0.001)(图1c)。
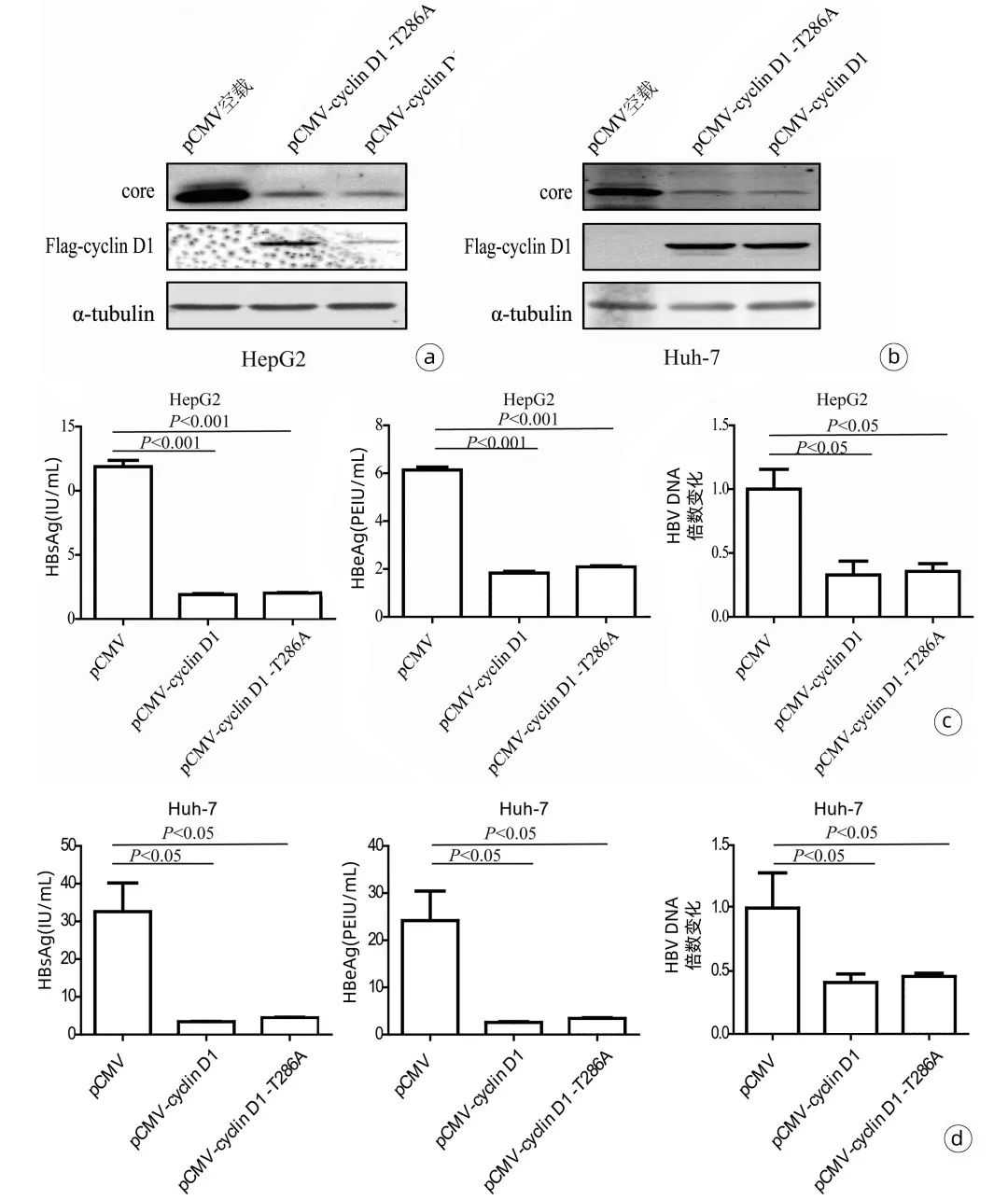
图1肝组织基因表达与血清HBVDNA的相关性分析
注:a,GSE84044数据集中与患者HBVDNA载量相关的肝组织宿主基因,样本按照HBVDNA载量的高低从左到右排列,蓝色代表低表达,红色代表高表达;b,765个与HBVDNA载量显著相关基因和116个细胞周期基因的交集;c,肝组织中CCND1水平与血清HBVDNA载量之间的相关性分析。
2.2外源表达cyclinD1抑制HBV复制为探究cyclinD1蛋白对HBV复制的影响,构建了pCMV-cyclinD1和pCMV-cyclinD1-T286A表达质粒,并将上述质粒分别与prcccDNA/pCMV-Cre质粒体系共同转染至HepG2及Huh-7细胞中,72h后收集细胞沉淀和细胞培养上清液。Westernblot实验证实pCMV-cyclinD1和pCMV-cyclinD1-T286A表达质粒均可在两种细胞中成功表达,且cyclinD1和cyclinD1(T286A)过表达均能显著降低细胞内HBVcore蛋白水平(图2a、2b)。与此结果一致,过表达cyclinD1和cyclinD1(T286A)亦显著下调了两种细胞上清液中的HBsAg、HBeAg和HBVDNA水平(图2c、d)。
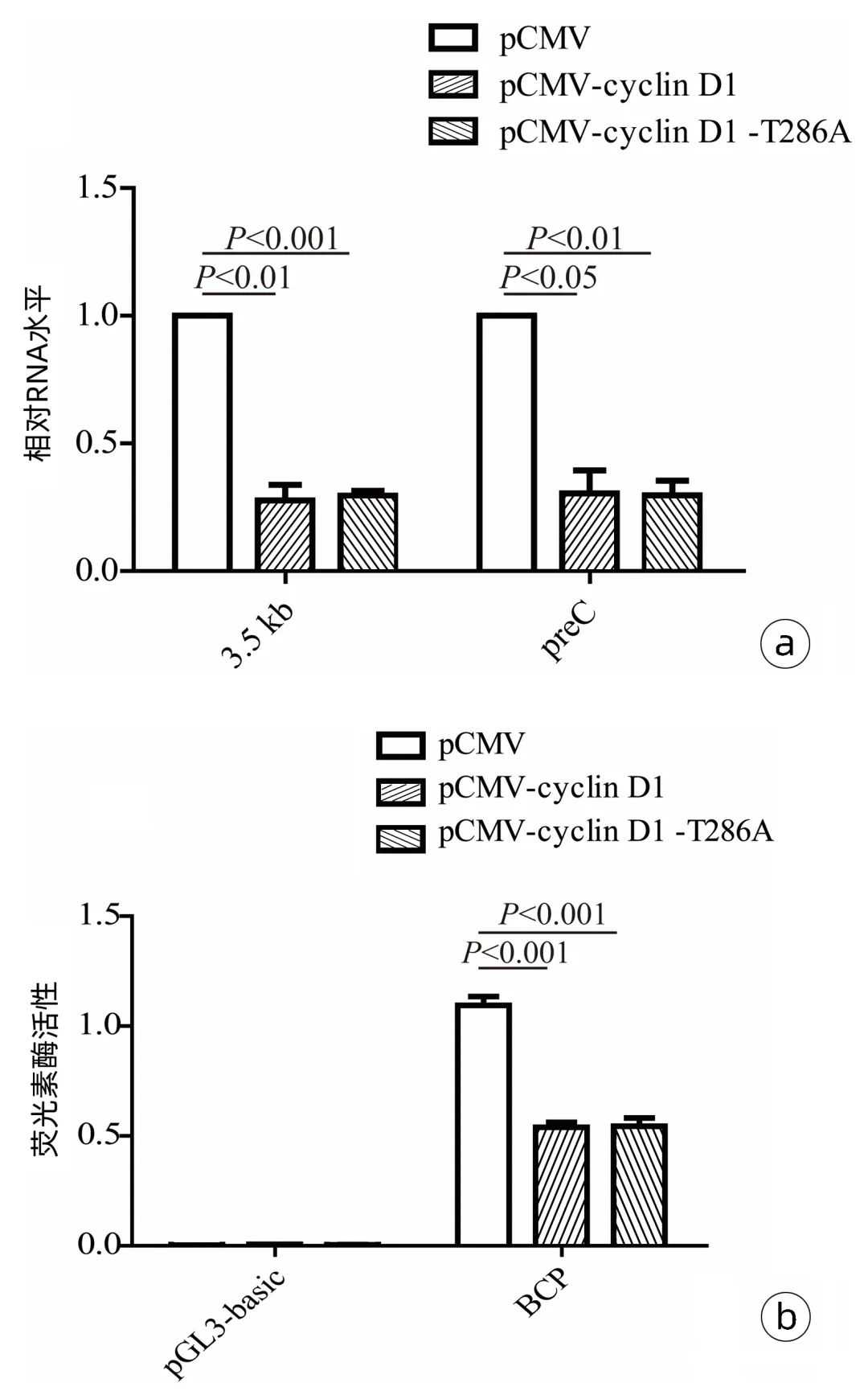
图2外源表达cyclinD1降低HBV的复制水平
注:a、b,外源表达cyclinD1降低HepG2和Huh-7细胞HBVcore蛋白的水平;c、d,外源表达cyclinD1下调HepG2和Huh-7细胞培养上清液中的HBsAg、HBeAg与HBVDNA水平。
2.3外源表达cyclinD1在转录水平抑制HBV复制为了探究cyclinD1蛋白抑制HBV复制的可能环节,采用RT-qPCR方法,在HepG2细胞中检测了cyclinD1和cyclinD1(T286A)对HBVRNA水平的影响。结果显示,过表达cyclinD1和cyclinD1(T286A)均可显著抑制HepG2细胞中HBV的3.5kbmRNA及preCmRNA水平(图3a)。与此一致,双荧光素酶报告基因实验证实,过表达cyclinD1和cyclinD1(T286A)均显著抑制了HBVBCP启动子活性(图3b)。
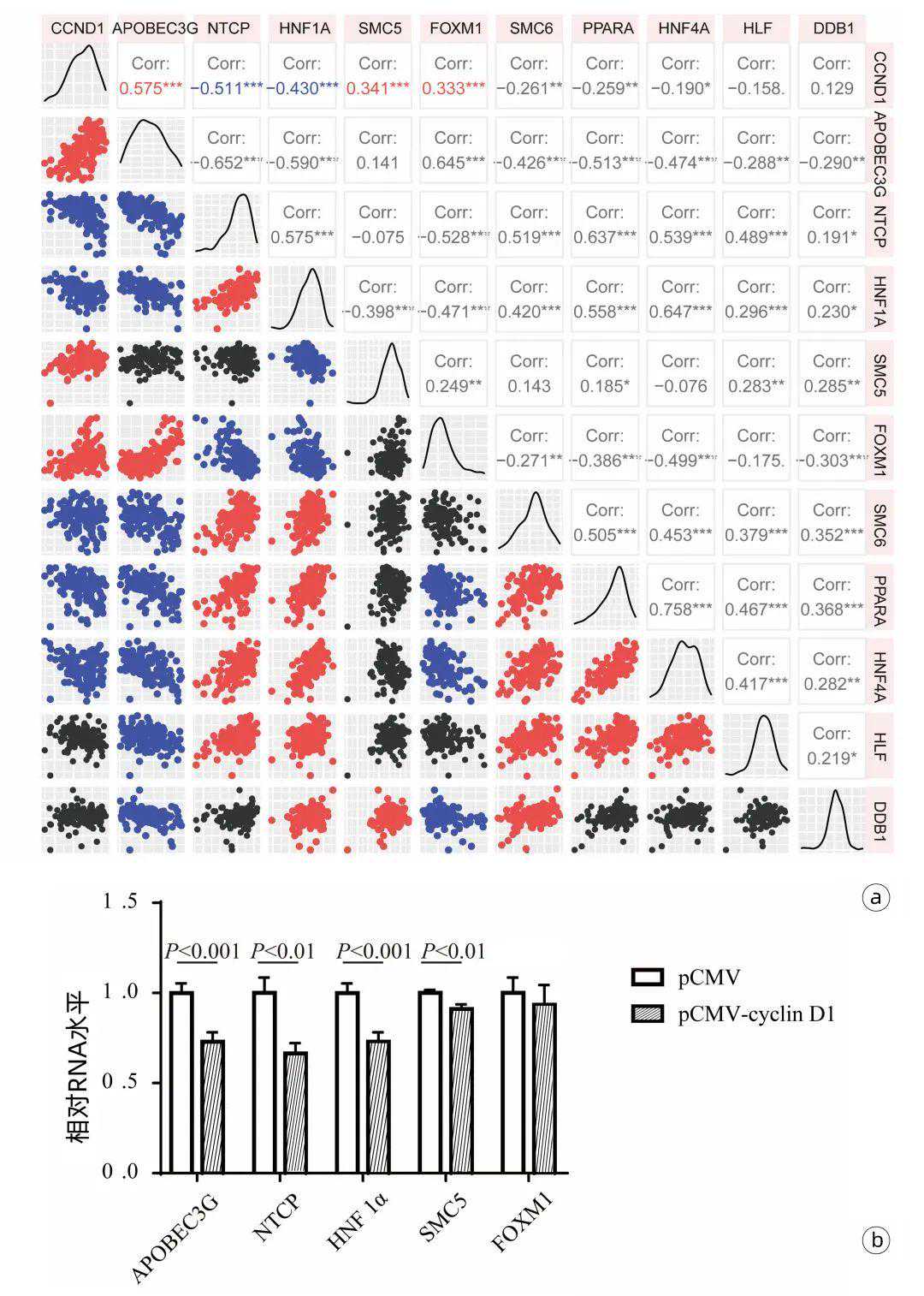
图3外源表达cyclinD1对HBV转录水平的影响
注:a,RT-qPCR检测cyclinD1和cyclinD1(T286A)过表达对HepG2细胞内HBVRNA的影响;b,双荧光素酶报告基因实验检测过表达cyclinD1和cyclinD1(T286A)对HBVBCP启动子活性的影响。
2.4cyclinD1通过下调HNF1α和NTCP表达抑制HBV复制为了进一步探究cyclinD1抑制HBV复制的可能机制,利用GSE83148数据集中122例CHB患者的肝脏转录组数据,分析了CCND1与10个已报道调控HBV复制的重要宿主基因的相关性(图4a)。结果显示,CCND1水平与抑制HBV复制的APOBEC3G(r=0.575,P<0.001)、SMC5(r=0.341,P<0.001)和FOXM1(r=0.333,P<0.001)表达呈显著正相关,而与HBV进入受体NTCP(r=-0.511,P<0.001)和HBV复制正向调控转录因子HNF1α(r=-0.430,P<0.001)表达呈显著负相关。采用RT-qPCR方法,对与CCND1表达相关性较高的APOBEC3G、NTCP、HNF1α、SMC5和FOXM1进行了定量分析。结果显示,在HepG2细胞中过表达cyclinD1降低了HNF1α(P<0.001)和NTCP(P<0.01)的RNA水平,同时也抑制APOBEC3G和SMC5表达(图4b)。

图4CCND1与HBV调控基因的表达相关性分析
注:a,CHB肝组织中CCND1与多个HBV调控基因的表达相关矩阵;b,RT-qPCR方法检测cyclinD1对HepG2细胞内APOBEC3G、NTCP、HNF1α、SMC5和FOXM1表达的影响。
3讨论
病毒需要依附活细胞才能完成其生命周期,故病毒与宿主细胞之间存在大量互作调控。已有研究[4]报道,HBV复制依赖于细胞周期,肝细胞的快速增殖可以抑制HBV复制,但其机制尚未阐明。本研究发现细胞周期调控关键蛋白cyclinD1可以抑制HBV复制,机制上可能与cyclinD1抑制HNF1α和NTCP表达有关。
已有研究[4]发现,HBV感染能使原代肝细胞富集于G2/M期,同时促HBV复制的细胞转录因子如PPARA、RXRA和CEBPB等也在HBV感染时上调,表明HBV复制可能更易在增殖抑制的肝细胞中复制。在增殖旺盛的肝癌组织中,HBVcccDNA及HBV复制水平则显著低于癌旁组织,进一步证实增殖的肝细胞不利于病毒复制[13]。与上述发现一致,本研究通过对GEO数据库的肝脏转录组数据集分析发现,有7个细胞周期调控相关的基因表达与患者血清HBVDNA载量呈负相关,分别为MYC、TGFB1、CCND1、YWHAZ、HDAC1、YWHAB和E2F3。其中,已有文献报道MYC[14]及TGFB1[15]可以通过不同机制抑制HBV的复制,这与本研究的分析结果相符合。HDAC抑制剂[5]如FK228/SAHA以及敲减HDAC1基因,均可通过上调p21诱导细胞发生G0/G1期阻滞,进而促进HBV复制。但CCND1、YWHAZ、YWHAB和E2F3是否影响HBV复制目前未见报道。
CCND1基因编码的蛋白产物为cyclinD1。cyclinD1是调控细胞周期由G0/G1期向S期转换的关键因子。cyclinD1可与CDK4/6形成复合物,进入细胞核内使RB蛋白磷酸化,并使后者失去对转录因子E2F的抑制,进而上调cyclinE、cyclinA的表达,从而启动细胞向S期转换。cyclinD1主要经泛素-蛋白酶体系降解,其出核主要由出核运输蛋白CRM1介导[16],CRM1与cyclinD1结合依赖于cyclinD1第286位苏氨酸(T286)磷酸化[17]。当T286A突变导致该磷酸化基序丢失时,突变cyclinD1主要定位于细胞核内,可促进细胞异常增殖。本研究发现,表达外源cyclinD1及cyclinD1(T286A)突变体均能显著抑制HBsAg、HBeAg及HBVDNA水平,以及细胞内HBVRNA和HBVcore蛋白水平,表明cyclinD1能抑制HBV复制。HBVBCP启动子主要调控3.5kbmRNA的转录,其中pgRNA既可作为mRNA翻译合成病毒core蛋白和P蛋白,也可作为反转录的模板在核衣壳内合成rcDNA,而preCmRNA则主要翻译外泌的HBeAg。本研究发现cyclinD1能显著抑制BCP区的转录活性,提示cyclinD1可在转录水平抑制HBV复制。笔者团队也注意到,cyclinD1及cyclinD1(T286A)突变体对HBV复制的抑制作用未见明显不同,且二者对HepG2和Huh7细胞增殖的影响也不大,可能与本研究采用的HBV复制模型是增殖速度较快的肝癌细胞株有关,未来需要在原代肝细胞中加以验证。
目前认为,细胞周期影响HBV复制的机制主要有3个方面:(1)抑制HBV进入肝细胞的功能性受体NTCP表达,从而抑制HBV的从头感染[13,18];(2)影响HBV复制调控分子的表达,如HNF4α、RXRA和CEBPB等[4],从而抑制HBV基因的转录;(3)影响HBV的成熟和释放[19-20]。本研究通过对数据分析发现,CHB患者肝组织中的CCND1与APOBEC3G、SMC5和FOXM1呈显著正相关,而与NTCP和HNF1α呈显著负相关。笔者团队的前期研究[13]发现,cyclinD1可抑制NTCP表达,提示cyclinD1也能抑制HBV对肝细胞的从头感染。HNF1α能够调控cccDNA的大部分调控元件(包括preS1启动子[21]、核心启动子[22]和增强子Ⅱ[23]),在HNF1α缺失的情况下HBV复制能力显著降低[24]。本研究进一步证实过表达cyclinD1能够抑制HNF1α和NTCP的表达,提示cyclinD1抑制HBV复制可能与其对HNF1α和NTCP的调控有关。
综上,本研究发现细胞周期关键蛋白cyclinD1可通过抑制HBV基因转录来抑制病毒复制,可为进一步阐明细胞周期调控HBV复制的分子机制提供理论依据,并为抗HBV新药研发提供潜在的分子靶点。
全文下载PDFHTML
引证本文Citation
彭思雯,关贵文,张婷,等.细胞周期素D1对HBV转录和复制的影响[J].临床肝胆病杂志,2023,39(2):316-324.
扩展阅读Readmore
临床研究|慢性乙型肝炎临床治愈者的血清sPD-1和sPD-L1水平及临床特点
临床研究|慢性乙型肝炎患者合并极轻肝脂肪变性的临床特征及危险因素分析
临床研究|富马酸替诺福韦酯治疗的慢性乙型肝炎患者3年血清HBVDNA和HBsAg的动态变化
临床研究|首次失代偿期乙型肝炎肝硬化患者获得再代偿的影响因素
关于本刊Aboutus
■我国首个肝胆病专业杂志
■金色开放获取期刊(GoldenOA)
■Scopus、DOAJ等12种国际重要数据库收录
■百种中国杰出学术期刊
■中国精品科技期刊
■中国百佳高校科技期刊
■《科技期刊世界影响力指数报告》收录期刊
■北京大学图书馆中文核心期刊
■中国科技论文统计源期刊
■RCCSE中国核心学术期刊(A)
官方网站:
官方
投稿咨询:
审稿咨询:
eGastroenterology
临床肝胆病杂志
中风与神经疾病杂志
中华神经创伤外科电子杂志